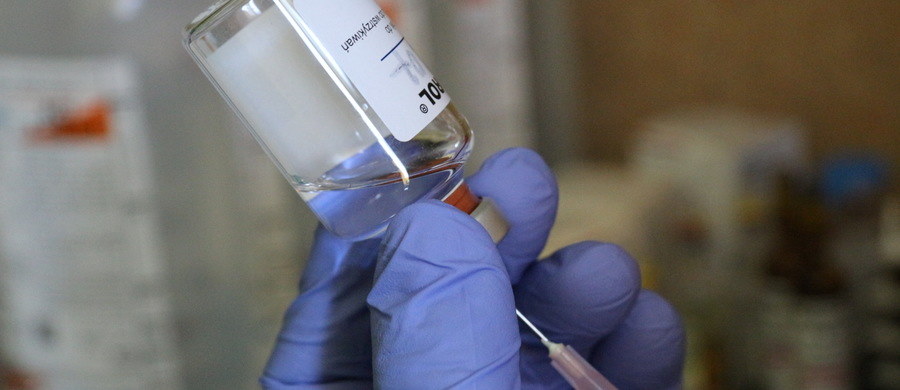
Polska podpisała umowy z trzema firmami na 45 milionów dawek szczepionek. Preparaty mogą zostać dopuszczone przez Europejską Agencję Leków już w ciągu kilku najbliższych tygodni. Akcja "Zaszczep się wiedzą" wyjaśnia proces wydania decyzji oraz podsumowuje, co wiemy o dostępnych szczepionkach oraz odporności na Covid-19.
Polska podpisała umowy na zamówienia szczepień z trzema firmami farmaceutycznymi: Pfizeri BioNTech Johnson&Johnson oraz AstraZeneca. Posiedzenie komisji Europejskiej Agencji Leków, zajmującej się dopuszczeniem do obrotu szczepionki firmy Pifzer BioNTech ma się odbyć najpóźniej 29 grudnia. Natomiast zgromadzenie dedykowane preparatowi Moderny zostało zaplanowane na 12 stycznia.
Opinia pozwalająca na dopuszczenie do obrotu może zostać wydana nawet w ciągu kilku tygodni. Istnieje zatem możliwość, że szczepienia przeciw Covid-19 rozpoczną się w Polsce już na przełomie stycznia i lutego.
Wydanie decyzji w tak szybkim tempie jest możliwe ze względu na dokonany już przez Europejską Agencję Leków rolling review. Przypomnijmy, że ta forma przeglądu stanowi narzędzie regulacyjne stosowane do przyspieszonej oceny obiecującego preparatu w sytuacji zagrożenia zdrowia publicznego.
W tradycyjnym trybie wszystkie dane dotyczące m.in. skuteczności i bezpieczeństwa oraz inne wymagane dokumenty muszą być gotowe już na początku oceny w formalnym wniosku. Natomiast przy rolling rewiev Komitet ds. Produktów Leczniczych Stosowanych u Ludzi dokonuje analizy danych w miarę ich udostępniania.
Warto pamiętać, że w trakcie pandemii zarówno Europejska Agencja Leków jak i jej komitety naukowe są wspierane przez specjalną grupę zadaniową. Skupia ona ekspertów z całej europejskiej sieci regulacyjnej leków. Do jej zadań należy m.in. doradztwo w zakresie opracowywania, zatwierdzania i monitorowania bezpieczeństwa leków i szczepionek.
Pfizer i BioNTech jako pierwszy poinformował o wstępnych wynikach badań III fazy swojego preparatu. Po 28 dniach od podania pierwszej dawki, w kilkumiesięcznym okresie obserwacji skuteczność szczepionki wyniosła ponad 90%. [1] W badaniach wzięło udział ponad 40 tysięcy dorosłych osób; u ani jednej nie odnotowano ciężkich niepożądanych odczynów poszczepiennych.
Preparat AstraZeneca, również w okresie kilku miesięcy dotychczasowej obserwacji, zapewnia ochronę przed Covid-19 do nawet 90%.[2] O wstępnych wynikach badań III fazy producent poinformował w oficjalnym komunikacie prasowym. W badaniach wzięło udział ponad 24 tysiące ochotników, u których nie zauważono ciężkich zdarzeń niepożądanych.
Johnson & Johnson poinformował we wrześniu o rozpoczęciu badań III fazy, w których weźmie udział nawet 60 tysięcy ochotników.[3]
Szczepienia przeciw COVID-19 będą dobrowolne i darmowe. Wszystkie zamówione przez Polskę preparaty są dwudawkowe, co oznacza, że do wytworzenia odporności wymagane jest odbycie dwóch wizyt szczepiennych w odstępie 21 dni. W pierwszej kolejności zaszczepieni zostaną: pracownicy ochrony zdrowia, mieszkańcy Domów Pomocy Społecznej i Zakładów Opiekuńczo-Leczniczych, seniorzy w wieku powyżej 60 lat oraz służby pracujące przy COVID-19 (m.in. policjanci i wojsko).
Kancelaria Premiera poinformowała na Twitterze, jak będzie przebiegać rejestracja na szczepienie.